著者:
Lewis Jackson
作成日:
8 5月 2021
更新日:
25 六月 2024

コンテンツ
正味のイオン方程式は、化学反応で変化する粒子のみを表すため、化学の重要な部分です。それらは、酸-塩基の酸化還元反応、代謝反応、および中和反応で最も一般的に使用されます。正味のイオン方程式を書くには、3つの基本的なステップがあります。分子方程式のバランスを取り、それを完全なイオン方程式(各物質が溶液中にどのように存在するか)に変換し、最後に正味のイオン方程式を書きます。
手順
パート1/2:イオン方程式の構成要素を理解する
分子との違いを知る イオン性化合物. 正味のイオン方程式を書くための最初のステップは、反応中のイオン化合物を決定することです。イオン性化合物は、水溶液中でイオンを解離し、電荷を持っているものです。分子化合物は、電荷を持たない化合物です。それらは2つの非金属間で形成され、共有化合物と呼ばれることもあります。
- イオン性化合物は、金属と非金属、金属と多原子イオン、または複数の多原子イオンの間で形成できます。
- 化合物が何かわからない場合は、周期表でその化合物の要素を探すことができます。

化合物の溶解性を認識します。 すべてのイオン性化合物が水溶液に溶解するわけではないため、イオンに解離することはできません。残りの式に進む前に、各化合物の溶解度を特定する必要があります。以下は、溶解性のルールの要約です。これらの規則の詳細と例外については、溶解度スプレッドシートを検索してください。- 以下に概説する順序でこれらのルールに従ってください。
- すべてのNa、K、およびNH塩4 すべて溶ける。
- すべてのNO塩3、C2H3O2、ClO3、およびClO4 すべて溶ける。
- すべてのAg、Pb、およびHg塩2 すべて溶解します。
- すべてのCl、Br、およびI塩は可溶性です。
- すべてのCO塩3、O、S、OH、PO4、CrO4、Cr2O7、 など3 解散します(いくつかの場合を除く)。
- すべてのSO塩4 すべてが溶解します(いくつかの場合を除く)。
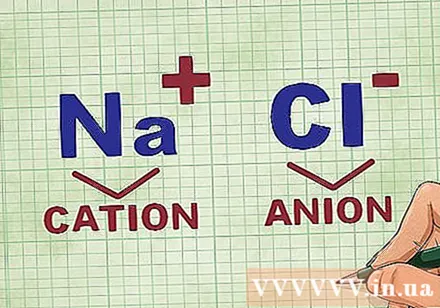
化合物中の陽イオンと陰イオンの測定。 カチオンは化合物の正イオンであり、通常は金属です。陰イオンは化合物の負イオンであり、非金属です。一部の非金属は陽イオンを形成できますが、金属は常に陽イオンを形成します。- たとえば、NaClでは、Naは金属であるため正に帯電した陽イオンであり、Clは非金属であるため負に帯電した陰イオンです。

反応中の多原子イオンを認識します。 多原子イオンは、互いにしっかりと結合し、化学反応中に解離しない荷電分子です。多原子イオンは特定の電荷を持ち、解離しないため、認識することが重要です。多原子イオンは、正または負の電荷を持つことができます。- 一般的な化学を研究している場合、いくつかの一般的な多原子イオンを覚えておく必要があることがよくあります。
- いくつかの一般的な多原子イオンはCOです3、 番号3、 番号2、 そう4、 そう3、ClO4 およびClO3.
- また、化学の本やインターネットで他の多くのイオンを見つけることができます。
パート2/2:正味のイオン方程式を書く
分子方程式のバランスを取ります。 正味のイオン方程式を書く前に、分子方程式のバランスが取れていることを確認する必要があります。方程式のバランスをとるには、各要素の原子数が方程式の両側で等しくなるように、化合物の前に係数を追加します。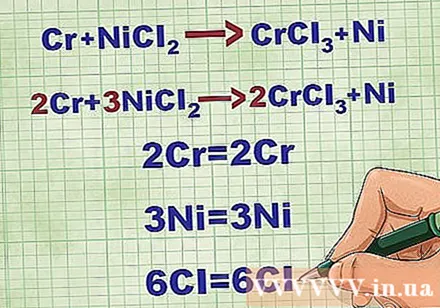
- 方程式の両側に、各化合物を構成する原子の数を記入します。
- 酸素と水素以外の要素の前に係数を追加して、両側のバランスを取ります。
- 水素原子バランス。
- 酸素原子バランス。
- 方程式の両側の原子の数を数え直して、バランスが取れていることを確認します。
- たとえば、Cr + NiCl2 -> CrCl3 + Ni 2Cr + 3NiClにバランス2 -> 2CrCl3 + 3Ni。
方程式で化合物の状態を特定します。 多くの場合、問題には各化合物の状態を知らせるキーワードがあります。要素または化合物の状態を判断するのに役立ついくつかのルールがあります。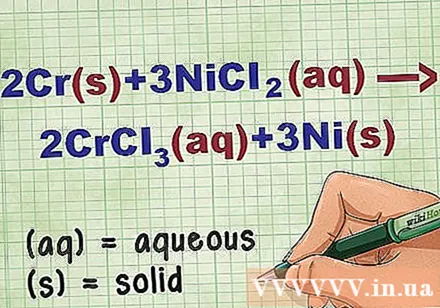
- 要素の状態が指定されていない場合は、周期表にある状態を使用してください。
- 化合物が溶液と呼ばれる場合、それを水性または(dd).
- 方程式に水が含まれている場合は、溶解度スプレッドシートを使用して、イオン性化合物が水溶性であるかどうかを判断する必要があります。溶解度が高い場合、化合物は水性になります(dd)、溶解度が低い場合、化合物は固体になります(r).
- 水がないと、イオン性化合物は固体です(r).
- 問題が酸性または塩基性の場合、化合物は水性です(dd).
- たとえば、2Cr + 3NiCl2 -> 2CrCl3 + 3Ni。 CrとNiの元素形態は固体状態です。 NiCl2 およびCrCl3 イオン性化合物は可溶性であるため、水性です。方程式を次のように書き直します:2Cr(r) + 3NiCl2(dd) -> 2CrCl3(dd) + 3Ni(r).
溶液中でどの化合物が解離するか(陽イオンと陰イオンに解離するか)を決定します。 物質または化合物が解離すると、正に帯電したイオン(陽イオン)と負に帯電したイオン(陰イオン)に解離します。これらは、正味のイオン方程式の最後で平衡化される成分です。
- 固体、液体、ガス、分子化合物、低溶解性イオン化合物、多原子イオン、弱酸は解離しません。
- イオン性化合物は溶解度が高く(溶解度表を使用)、強酸は100%イオン化します(HCl(dd)、HBr(dd)、 こんにちは(dd)、H2そう4(dd)、HClO4(dd)、およびHNO3(dd)).
- 多原子イオンはそれ以上解離しませんが、それらがその化合物の構成要素である場合、それらは化合物から解離することに注意してください。
化合物から解離した各イオンの電荷を計算します。 金属は正のイオンを形成し、非金属は負のイオンを形成することを忘れないでください。周期表を使用して、要素の料金を決定します。また、化合物の各イオンの電荷のバランスをとる必要があります。
- この例では、NiCl2 CrClがNiとClに解離する3 CrとClに分割します。
- Clは負の電荷を持っていますが、2つの原子を持っているため、Niの電荷は2+です。したがって、2つの負のClイオンのバランスをとる必要があります。 Crは3+の電荷を持っているので、3つの負のClイオンのバランスをとる必要があります。
- 多原子イオンには特定の電荷があることを忘れないでください。
完全なイオン方程式を書き留めます。 解離またはイオン化するもの(強酸)は、2つの別々のイオンに分離します。物質の状態は残ります(dd)、ただし、方程式のバランスが保たれていることを確認してください。
- 固体、液体、ガス、弱酸、および溶解度の低いイオン性化合物は、状態を変化させたり、イオンに分離したりしません。私たちはそれらを無傷に保ちます。
- 分子物質は溶液中に分散するため、状態は(dd)。 3つの例外 ない になる(dd)は:CH4(k)、C3H8(k)、およびC8H18(l).
- 上記の例を続けると、完全なイオン方程式は次のようになります。2Cr(r) + 3Ni(dd) + 6Cl(dd) -> 2Cr(dd) + 6Cl(dd) + 3Ni(r)。 Clが化合物に含まれていない場合、それは双極ではないため、係数に化合物の原子数を掛けて、方程式の両側に6つのClイオンを求めます。
方程式の両側で同じイオンをキャンセルして、平衡イオンを削除します。 キャンセルできるのは、両側(電荷、原子番号など)がまったく同じ場合のみです。破壊可能な物質なしで方程式を書き直してください。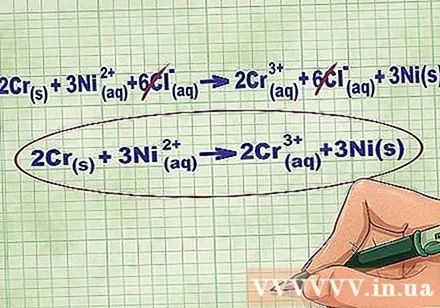
- 例を完了すると、両側に6つのキャンセル可能なCl平衡イオンがあります。正味のイオン方程式は2Crです(r) + 3Ni(dd) -> 2Cr(dd) + 3Ni(r).
- あなたが正しければ、反応物側の総電荷は、正味のイオン方程式の生成物側の総電荷と等しくなければなりません。
助言
- あなたでない場合は、方程式のすべての物質の状態を書き留めます 意志 ポイントを失います。